
科目: 来源: 题型:解答题
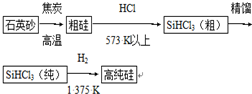
查看答案和解析>>
科目: 来源: 题型:选择题
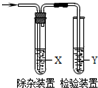 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
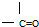 ②
②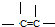 ③
③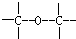 ④
④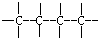
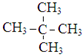
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
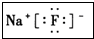 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_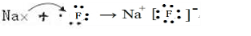
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应中的能量变化,都表现为热量的变化 | |
| B. | 熔融态导电的一定是离子化合物 | |
| C. | 构成单质分子的微粒中一定含有化学键 | |
| D. | 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目: 来源: 题型:解答题
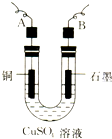 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
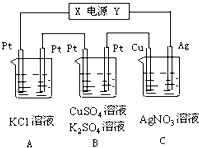 如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:
如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com