
科目: 来源: 题型:选择题
| A. | 蛋白质中只含C、H、O三种元素 | |
| B. | 许多油脂兼有烯烃和酯的性质,可以发生加成反应和水解反应 | |
| C. | 糖类的主要成分是高级脂肪酸甘油酯 | |
| D. | 所有糖、油脂、蛋白质都能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 丙烯(CH2=CH-CH3)和环丙烷组成的42g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容器内气体C的物质的量不再改变 | |
| B. | 容器内混合气体的A、B、C的浓度之比为1:3:2 | |
| C. | 单位时间内生成 n mol的A,同时消耗2n mol的C | |
| D. | 正、逆反应均不再进行 |
查看答案和解析>>
科目: 来源: 题型:解答题
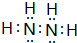 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用催化氢化法除去甲烷中的少量乙烯 | |
| B. | 苯与液溴反应,苯与H2反应属于同一类型的反应 | |
| C. | 苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应 | |
| D. | 丙炔可以发生取代反应,加成反应、加聚反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极 | |
| B. | HBr的沸点比HCl高,那么HCl的沸点比HF高 | |
| C. | 硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目: 来源: 题型:解答题
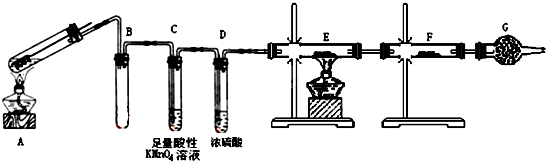
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com