
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
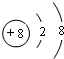 ;元素Y在周期表中位于第ⅣA族.
;元素Y在周期表中位于第ⅣA族.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| d | ||
| a | b | c |
| A. | c的简单离子的电子层数等于其所在周期的周期序数 | |
| B. | d的氢化物的稳定性比b的氢化物强 | |
| C. | 原子半径的大小顺序是:c>b>a>d | |
| D. | 在a、b、c的最高价氧化物对应水化物中,酸性最强的是c的最高价氧化物对应水化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| C. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 | |
| D. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 | |
| B. | Cl2、SO2都能使紫色石蕊试液与品红溶液褪色 | |
| C. | 相同质量的Cu分别与过量的体积相同的浓硝酸、稀硝酸反应,反应中铜失去的电子数相等 | |
| D. | 32g Cu与50mL 18.4mol/L的硫酸溶液共热,充分反应后,被还原的H2SO4为0.46mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制光导纤维的材料是晶体硅 | |
| B. | 二氧化硫和某些含硫化合物的漂白作用可用来加工食品,以使食品增白 | |
| C. | 常温下可以用铁、铝制容器来盛装浓硫酸或浓硝酸 | |
| D. | 水晶和陶瓷都是硅酸盐产品 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 操 作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| ③ | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2 混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①⑤⑥ | B. | ②③⑤ | C. | ①④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com