
科目: 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的或实验结论 |
| ① | 利用一束强光照射矾溶液,产生光亮的“通路”. | 说明明矾一定发生了水解 |
| ② | 向bmL0.1mol/LAgNO3溶液中滴加1mL0.1mol/LNaCl溶液,有白色沉淀生成,再向其中滴加1mL0.1mol/LKI溶液,有黄色沉淀生成. | 验证AgCl的溶解度比AgI大 |
| ③ | 向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氧化碳振荡,四氧化碳层呈紫色 | 说明白色沉淀可能为CuI |
| ④ | 室温下,分别向2支试管中加入相同体积,相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| ⑤ | 将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象 | 说明HNO3将Fe氧化成Fe2+ |
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标准状况下80gSO2与33.6LCO2含氧原子数目均为3NA | |
| B. | 2molNO与1molO2混合后气体分子数小于2NA | |
| C. | 电解精炼铜时,阳极上粗铜质量减少6.4g,则电路中转化电子数为0.2NA | |
| D. | 1molCnH2n(烯烃)含有的共用电子对数为3nNA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 对肾功能衰竭病人进行“血液透析” | |
| B. | 用热的纯碱溶液清除餐具上沾有的油污 | |
| C. | 常温下用铝罐贮藏贮运浓硫酸 | |
| D. | 对石油进行分馏,裂化获得汽油 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. |  N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. |  2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. |  2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目: 来源: 题型:解答题
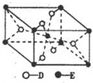
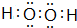 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com