
科目: 来源: 题型:选择题
| A. | 活性炭、C60、金刚砂都是碳的同素异形体 | |
| B. | Fe2O3、Na2O2、K2O都是碱性氧化物 | |
| C. | 淀粉、蛋白质、油脂都属于有机高分子化合物 | |
| D. | 纯碱、氯化铵、明矾都是盐且都属于强电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
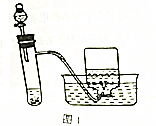
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
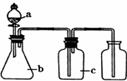 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
查看答案和解析>>
科目: 来源: 题型:选择题
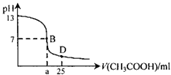 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com