
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
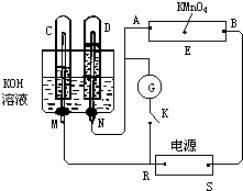
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
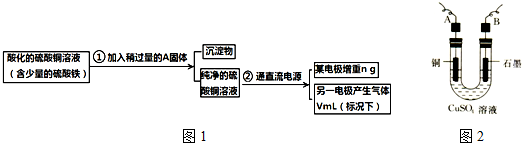
查看答案和解析>>
科目: 来源: 题型:解答题
 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
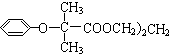
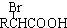 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$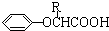
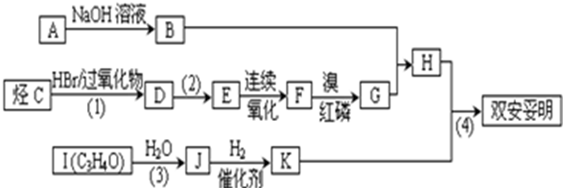
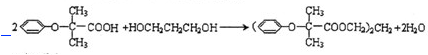
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
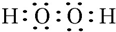 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol | |
| B. | 咖啡酸分子中至少有9个碳原子共平面 | |
| C. | 咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应 | |
| D. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| B. | 用将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红的方法来检验Fe(NO3)2晶体是否变质 | |
| C. | 锥形瓶可用作加热的反应器 | |
| D. | 只滴加氨水可以鉴别出NaCl、AlCl3、Na2SO4、MgCl2四种溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com