
科目: 来源: 题型:选择题
| A. | D、E以原子个数比2:1形成的化合物,只含离子键 | |
| B. | 元素A、B、C的单质晶体可能属于同种类型的晶体,也可能是不同类型的晶体.如果B在A2B7CD分子中有四种不同的环境,则该分子不能与硫酸反应 | |
| C. | 含E的某种离子的水溶液,滴加某种含A、C或A、C、D元素组成的离子的溶液,均可生成配合物 | |
| D. | B与C形成的化合物其沸点一定高于A与B形成的化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 右列图标均与燃烧和爆炸有关 | |
| B. | 棉、麻、蚕丝、羊毛及合成纤维都属于纤维,但均不含纤维素 | |
| C. | 科学家用单个分子制成了“纳米车”,它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞.“纳米车”说明在一定条件下,分子的热运动须在人工操纵下才能进行 | |
| D. | 捕获工业排放的CO2,既能降低地球的温室效应又能用来合成聚碳酸酯可降解塑料,实现碳的循环利用 |
查看答案和解析>>
科目: 来源: 题型:解答题
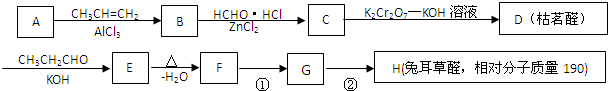
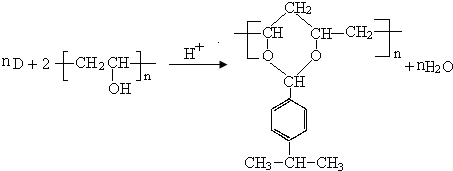
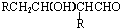 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$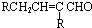
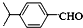 .
.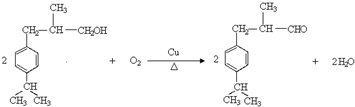 .
.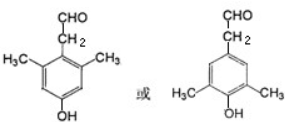 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
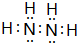 ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | SiO2能形成原子晶体,一定条件下CO2也能形成原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com