
科目: 来源: 题型:填空题
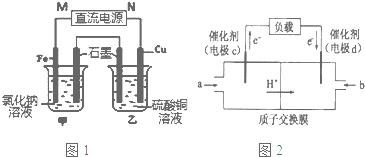
查看答案和解析>>
科目: 来源: 题型:填空题
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
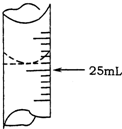 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲型H1N1流感病毒是一种油脂 | |
| B. | 我们所吃的豆腐中主要含有蛋白质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 糯米中的淀粉一经发生水解反应就酿造成酒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com