
科目: 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 由苯制硝基苯 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
查看答案和解析>>
科目: 来源: 题型:解答题
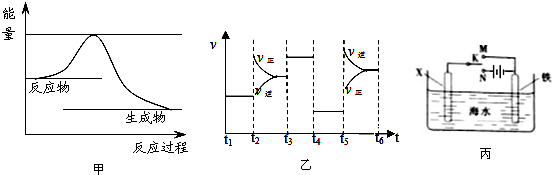
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- | |
| B. | 向1 mo1•L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| C. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol•L-1,c(CO32-)=0.0001 mol•L-1,此时Mg2+和CO32-不能共存 |
查看答案和解析>>
科目: 来源: 题型:解答题
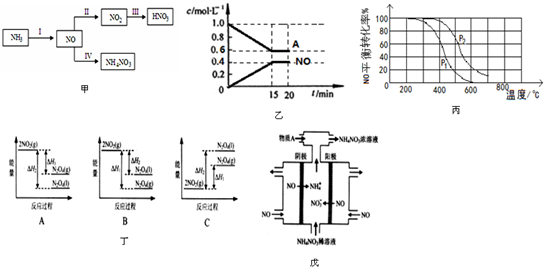
查看答案和解析>>
科目: 来源: 题型:解答题
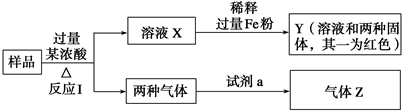
查看答案和解析>>
科目: 来源: 题型:解答题
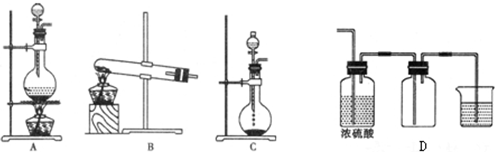
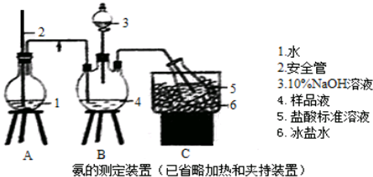
查看答案和解析>>
科目: 来源: 题型:解答题
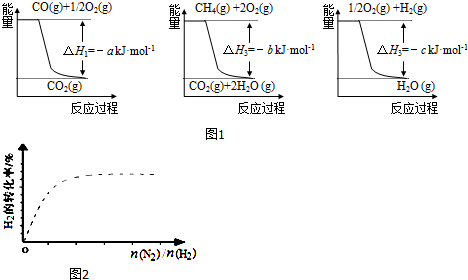
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HA的pH=3;BOH的pH=13 | |
| B. | pH=a的HA溶液,稀释10倍,其pH=a+1 | |
| C. | 等体积的HA和BOH恰好完全反应,溶液的pH=7 | |
| D. | 相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | I-和IO-都是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com