
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
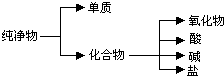 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铝和氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| B. | 硫酸溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氯化铝中加入过量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目: 来源: 题型:选择题
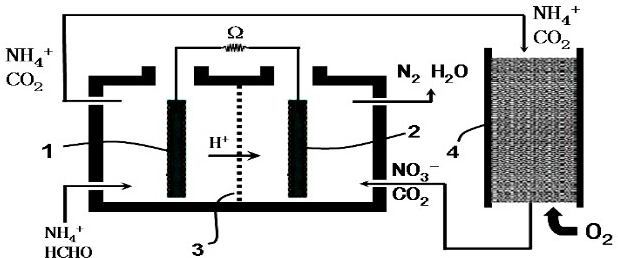
| A. | 负极发生的反应为:HCHO-4e-+H2O═CO2+4H+ | |
| B. | 负极所在的左室中需保持厌氧环境 | |
| C. | NH4+通过循环操作最终被转化成N2 | |
| D. | O2参与正极反应,发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
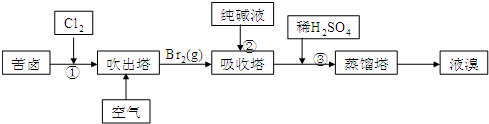
查看答案和解析>>
科目: 来源: 题型:填空题
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
查看答案和解析>>
科目: 来源: 题型:选择题
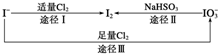
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com