
科目: 来源: 题型:选择题
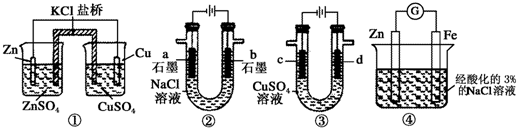
| A. | 装置①中,一段时间后SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,a极附近变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中发生吸氧腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,测得反应过程中醋酸产生H2速率较慢且最终产生H2较多,则可证明醋酸为弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由于甲酸的缘故,人被蜂蚁蜇咬后会感觉疼痛难忍,涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| B. | 用浸过酸性高锰酸钾溶液的硅藻土吸收水果、花朵产生的乙烯,可以延长果实或花朵的成熟期 | |
| C. | 将金属与电源正极相连可有效保护金属不被腐蚀 | |
| D. | 泡沫灭火器利用双水解原理喷出泡沫覆盖在燃烧物品上,使燃着的物质与空气隔离,并降低温度,达到灭火的目的 |
查看答案和解析>>
科目: 来源: 题型:解答题
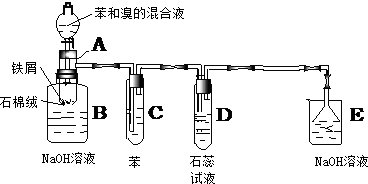

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
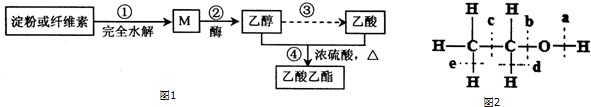
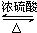 CH3 CH2CO18OCH2CH3+H2O.
CH3 CH2CO18OCH2CH3+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
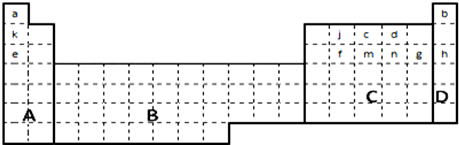
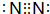 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com