
科目: 来源: 题型:解答题
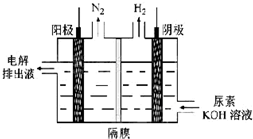 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
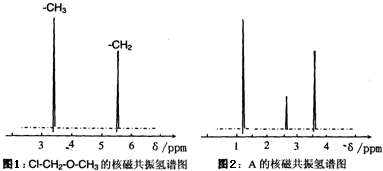
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
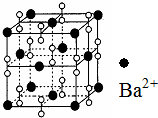 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
查看答案和解析>>
科目: 来源: 题型:解答题
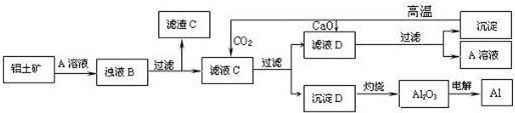
查看答案和解析>>
科目: 来源: 题型:解答题
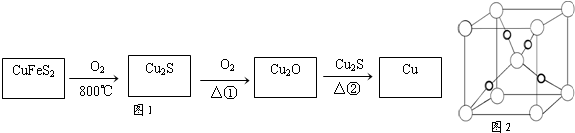
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都是石灰石 | |
| B. | 钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 | |
| C. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| D. | 铝制品在空气中不易被腐蚀,是因为常温下铝不与氧气反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com