
科目: 来源: 题型:解答题
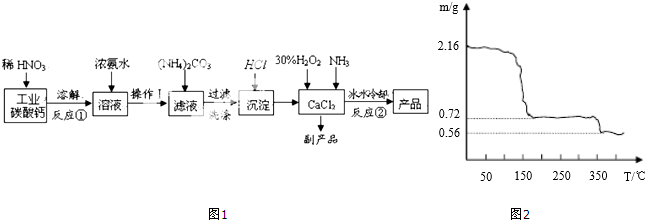
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
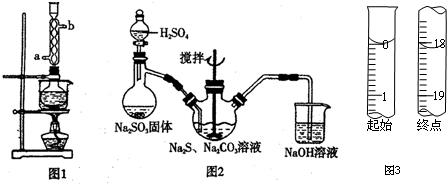
查看答案和解析>>
科目: 来源: 题型:填空题
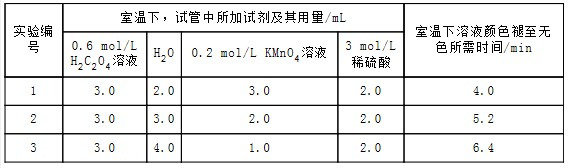
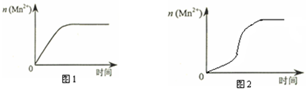
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
查看答案和解析>>
科目: 来源: 题型:解答题
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
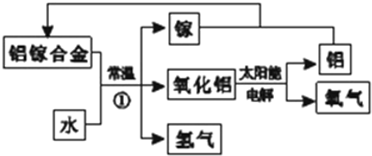 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeO、Fe2O3、Na2O2均为碱性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 盐酸、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 属于金属元素 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com