
科目: 来源: 题型:选择题
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 2009年2月21日,法国佳士得拍卖行“伊去•圣洛朗与皮埃尔•贝尔热珍藏”专物拍卖会拍卖品预展在法国巴黎大皇宫拉开帷幕.25日,中国圆明园流失文物鼠首和兔首铜像被拍卖.普通铜器的时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3.这两件铜铸的国宝仍然熠熠生辉不生锈,下列对其主要原因的分析,最可能的是( )
2009年2月21日,法国佳士得拍卖行“伊去•圣洛朗与皮埃尔•贝尔热珍藏”专物拍卖会拍卖品预展在法国巴黎大皇宫拉开帷幕.25日,中国圆明园流失文物鼠首和兔首铜像被拍卖.普通铜器的时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3.这两件铜铸的国宝仍然熠熠生辉不生锈,下列对其主要原因的分析,最可能的是( )| A. | 它们的表面都镀上了一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶液溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
查看答案和解析>>
科目: 来源: 题型:解答题
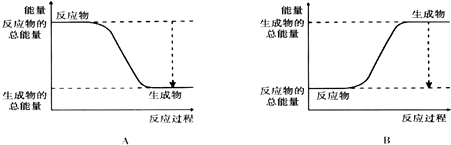
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
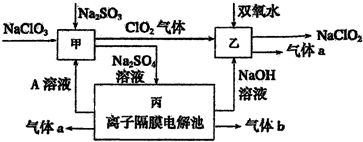
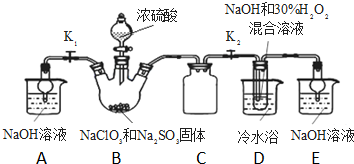 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
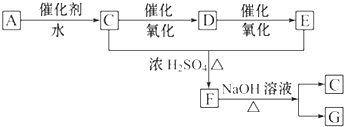
 亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
查看答案和解析>>
科目: 来源: 题型:解答题
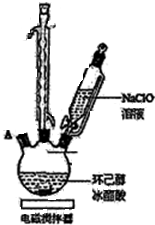 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |
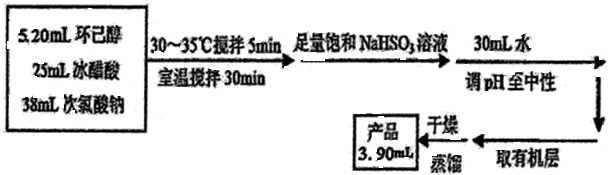
 .
. ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com