
科目: 来源: 题型:解答题
 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
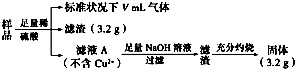
| A. | V=44.8 | |
| B. | 原样品中Fe元素的质量分数为38.89% | |
| C. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| D. | 样品中CuO的质量为4.0 g |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是最内层电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
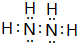 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 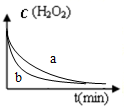 图表示双氧水分解时反应物浓度随时间的变化情况,a为加入少量FeCl3时的变化情况 | |
| B. | 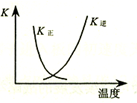 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 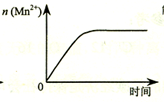 图表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 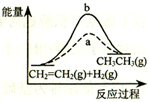 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H>0反应过程中的能量变化,a为不加催化剂时的过程 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只含极性键的共价化合物 | |
| B. | 含非极性键的共价化合物 | |
| C. | 阴阳离子个数之比为1:1的离子化合物 | |
| D. | 可形成双核离子或者四核离子 |
查看答案和解析>>
科目: 来源: 题型:解答题
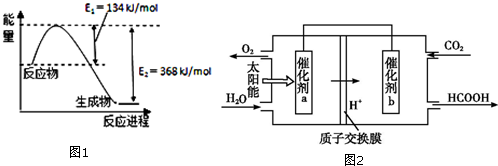
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+ 对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱的多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物鉴定,${\;}_{\;}^{12}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有机物一定含有C元素 | |
| B. | 能够写出电离方程式的物质在书写离子方程式中一定可以拆 | |
| C. | 有机物中不可能含有金属元素 | |
| D. | AlCl3 属于离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com