
科目: 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
 _(R用元素符号表示).
_(R用元素符号表示).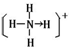 ,含有的化学键类型共价键、配位键.
,含有的化学键类型共价键、配位键.
查看答案和解析>>
科目: 来源: 题型:填空题
 ,E离子的电子排布式为1s22s22p6,B原子的电子排布图为
,E离子的电子排布式为1s22s22p6,B原子的电子排布图为 .
.查看答案和解析>>
科目: 来源: 题型:填空题
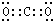 .
.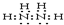
查看答案和解析>>
科目: 来源: 题型:解答题
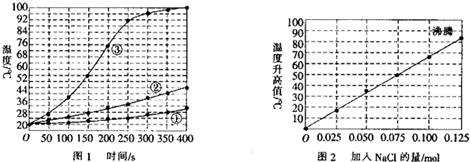
查看答案和解析>>
科目: 来源: 题型:选择题
 一定条件下,在某恒容容器中充人N2和H2,反应N2+3H2?2NH3(正反应放热)达到平衡.当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合图中变化的是( )
一定条件下,在某恒容容器中充人N2和H2,反应N2+3H2?2NH3(正反应放热)达到平衡.当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合图中变化的是( )| A. | 充入氮气同时分离出氨 | B. | 升高温度 | ||
| C. | 减小压强 | D. | 增大压强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素编号 | 元素性质或原子结构 |
| X | 形成的简单阳离子核外无电子 |
| Y | 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应 |
| Z | 元素在周期表的族序数等于周期序数的3倍 |
| T | 同周期元素中形成的简单离子半径最小 |
| A. | 原子半径大小顺序:T>Z>Y>X | |
| B. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气 | |
| C. | X分别与Y、Z均可形成既含极性键又含非极性键的化合物 | |
| D. | 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用 |
查看答案和解析>>
科目: 来源: 题型:解答题
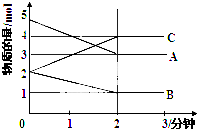 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.查看答案和解析>>
科目: 来源: 题型:解答题
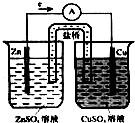 如图是铜锌原电池,又称丹尼尔电池.请回答:
如图是铜锌原电池,又称丹尼尔电池.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3OH和CH3OCH3 | B. | HCOOH和C17H33COOH | ||
| C. | CH3CH2CH2Br和CH3CHBrCH3 | D. |  和 和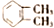 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com