
科目: 来源: 题型:选择题
| A. | 用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数约为0.2NA | |
| C. | 标准状况下,22.4L氖气中含有NA个氖原子 | |
| D. | 1mol甲基所含电子数约为8NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ⅰ和II两途径达到平衡时,体系内各成分的体积分数相同 | |
| B. | 达到平衡时,Ⅰ途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2) | |
| C. | 达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍 | |
| D. | 达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的$\frac{1}{2}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 检验某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100mL1mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100ml1mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝制容器可盛装热的浓H2SO4 | |
| B. | AgI胶粒在电场中自由运动 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molC2H6O中含有C-C键的数目一定为NA | |
| B. | 25℃,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA | |
| C. | 标准状况下,2.24L异丁烷含有的分子数目为0.1NA | |
| D. | 常温常压下,0.3molNO2与足量H2O充分反应,转移电子的数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2O3呈红棕色,可用做红色颜料 | |
| B. | 浓硫酸能腐蚀金属,不能用任何金属容器盛装浓硫酸 | |
| C. | 氯气有毒,利用这一性质可进行自来水的杀菌消毒 | |
| D. | 镁、铝都比较软,不能用做装饰材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在空气中易被氧化,需将其保存在酒精中 | |
| B. | 能使润湿的红色石蕊试纸变成蓝色的气体一定是NH3 | |
| C. | 向某有色溶液中通入SO2气体,溶液变为无色,证明SO2具有漂白性 | |
| D. | 向某溶液中加入BaCl2溶液,产生能溶于稀盐酸的白色沉淀,该溶液一定含有CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
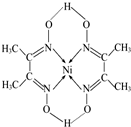 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com