
科目: 来源: 题型:选择题

| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
查看答案和解析>>
科目: 来源: 题型:解答题
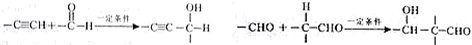

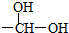 极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).
极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).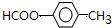 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
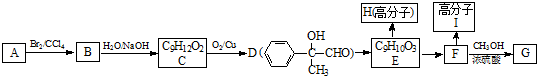
 .
. ;②F→G
;②F→G .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com