
科目: 来源: 题型:多选题
| A. | CO2分子的结构式:O=C=O | |
| B. | 氯气分子的电子式 Cl:Cl | |
| C. | Cl-的离子结构示意图: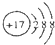 | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}O$ |
查看答案和解析>>
科目: 来源: 题型:填空题
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目: 来源: 题型:解答题
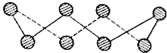 (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.查看答案和解析>>
科目: 来源: 题型:解答题
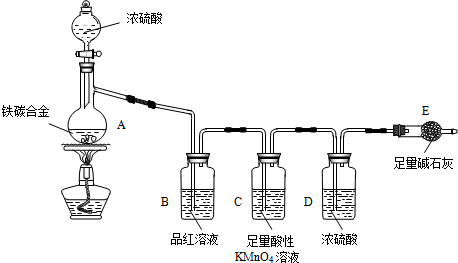
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ⑥ | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
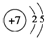 ,⑩的元素名称:溴
,⑩的元素名称:溴 .
.查看答案和解析>>
科目: 来源: 题型:解答题
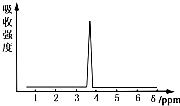 在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.查看答案和解析>>
科目: 来源: 题型:解答题
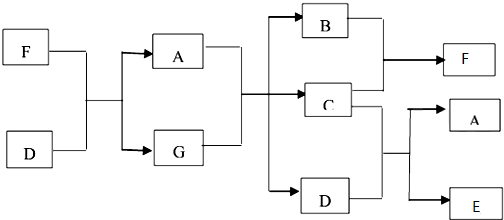
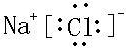 ,C
,C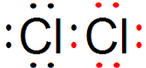 ,D
,D ,F
,F ,E
,E ;
;查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的一种单质是自然界中硬度最大的物质 | |
| C. | 元素Y的单质只能与盐酸等酸反应生成氢气,而不能和碱反应 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com