
科目: 来源: 题型:解答题
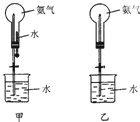 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)| 气体 | 液体 | |
| A | NO2 | 水 |
| B | CO2 | 4mol•L-1NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 可以存在-3、+5等多种化合价 |
查看答案和解析>>
科目: 来源: 题型:填空题
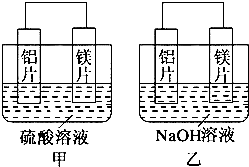
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.0g | B. | 3.5g | C. | 5.5g | D. | 5.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 试液→(KSCN溶液)→颜色无变化→(+氯水)→溶液变成血红色,证明溶液中含有Fe2+ | |
| B. | 试液→(焰色反应)→产生黄色,证明溶液为氢氧化钠溶液 | |
| C. | 试液→(+石蕊)→溶液呈蓝色,证明试液一定是碱溶液 | |
| D. | 混合气体→(通过澄清石灰水)→变浑浊,证明混合气体中一定含有二氧化碳 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②在电解开始阶段,b极附近溶液的pH增大 | |
| C. | 可以用装置③在银上镀铜,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
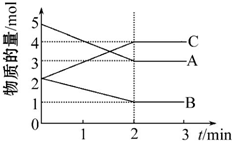
查看答案和解析>>
科目: 来源: 题型:解答题
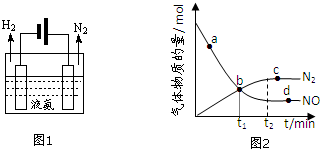
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com