
科目: 来源: 题型:选择题
| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目: 来源: 题型:填空题
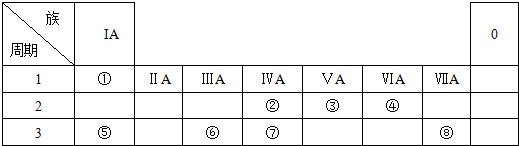
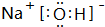
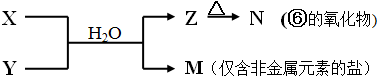
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO3-、Cu2+、Cl-、NH4+ | B. | K+、CO32-、Ca+、NO3- | ||
| C. | HCO3-、Na+、NO3-、K+ | D. | Cl-、SO42-、Na+、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
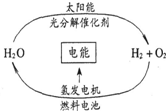 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )| A. | 燃料电池能够使化学反应产生的能量转化为电能 | |
| B. | 在此循环中发生了反应:2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+O2↑ | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质在溶液里达到电离平衡时,溶质电离出的离子浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 | |
| C. | 电离平衡时,弱电解质分子电离成离子的速率为零 | |
| D. | 电解质达到电离平衡后,各种离子的浓度不再变化 |
查看答案和解析>>
科目: 来源: 题型:填空题
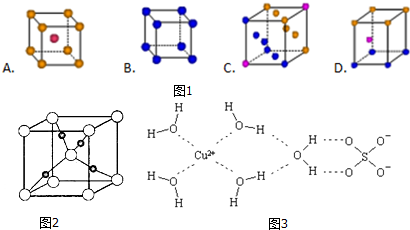
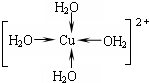 .
.查看答案和解析>>
科目: 来源: 题型:填空题
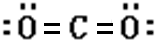 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com