
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
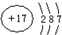 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024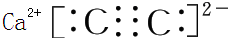
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
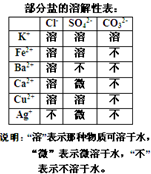 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | Fe2+和Fe3+物质的量之比为5:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 糖类物质都具有相同的官能团 | |
| C. | 油脂的皂化反应生成高级脂肪酸和甘油 | |
| D. | 蛋白质的水解产物都含有羧基和羟基 |
查看答案和解析>>
科目: 来源: 题型:解答题
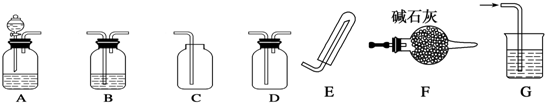
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com