
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )
可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )| A. | 温度降低,化学平衡向逆方向移动 | |
| B. | 使用催化剂,D的物质的量分数增加 | |
| C. | 化学方程式系数m<r+q. | |
| D. | 物质B的颗粒越小,反应越快有利于平衡向正向中移动 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.43 kJ | B. | 4.86 kJ | C. | 43.8 kJ | D. | 87.5 kJ |
查看答案和解析>>
科目: 来源: 题型:填空题
 系统法命名:2,4-二甲基-3-乙基己烷.
系统法命名:2,4-二甲基-3-乙基己烷.查看答案和解析>>
科目: 来源: 题型:填空题
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
 (用电子式表示)
(用电子式表示)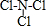 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 金属(粉末状) | 酸的浓度及体积 | 反应温度 | |
| A | Mg 0.1g | 18.4mol•L-1硫酸10mL | 80℃ |
| B | Mg 0.1g | 1.5mol•L-1盐酸10mL | 60℃ |
| C | Fe 0.1g | 1mol•L-1盐酸 10mL | 60℃ |
| D | Mg 0.1g | 1mol•L-1硫酸10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com