
科目: 来源: 题型:解答题
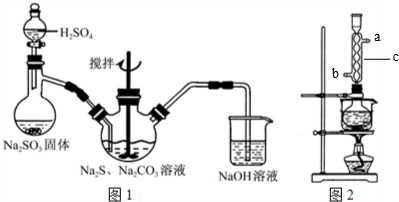
查看答案和解析>>
科目: 来源: 题型:解答题
 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.查看答案和解析>>
科目: 来源: 题型:解答题
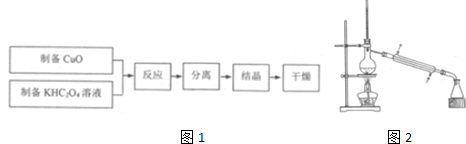
查看答案和解析>>
科目: 来源: 题型:解答题
| X | Y | Z | M |
| R | W |
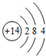 .
.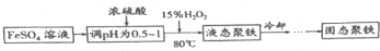
查看答案和解析>>
科目: 来源: 题型:解答题
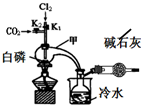 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径大小顺序:C>D>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最高的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2SiO3溶液与盐酸 | B. | CO2与足量石灰水 | ||
| C. | NaOH溶液与NaAlO2溶液 | D. | NaOH溶液与NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com