
科目: 来源: 题型:选择题
| A. | 甲烷的球棍模型: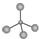 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: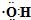 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化. ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.查看答案和解析>>
科目: 来源: 题型:解答题
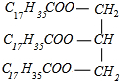 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+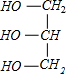
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) | |
| C. | NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目: 来源: 题型:填空题
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目: 来源: 题型:选择题
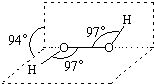 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )| A. | 过氧化氢分子中存在离子键、共价键 | |
| B. | 在1.00mol H2O2中,核外电子总数为10×6.02×1023个 | |
| C. | 过氧化氢既有氧化性又有还原性 | |
| D. | 3.4g过氧化氢中含有6.02×1022个原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制取乙烯时用酸性高锰酸钾溶液检验产物 | |
| B. | 除乙酸乙酯中少量的乙酸用足量氢氧化钠溶液充分反应后分液即可 | |
| C. | 检验淀粉水解是否完全将水解液中加碱至碱性后加入碘水 | |
| D. | 苯、硝基苯、乙醇、乙酸四种物质只用碳酸氢钠溶液一种试剂就能鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com