
科目: 来源: 题型:解答题
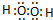 ,该分子含有极性键和非极性键(填“极性”、“非极性”)键
,该分子含有极性键和非极性键(填“极性”、“非极性”)键查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
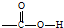
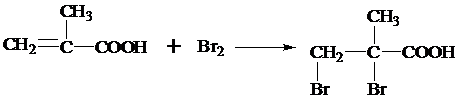 ,反应类型为加成反应.
,反应类型为加成反应.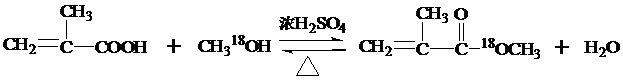 ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为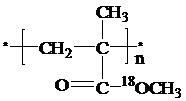 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | |||
| 4 | ② | ④ |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
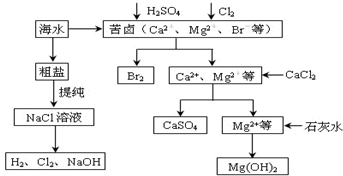

查看答案和解析>>
科目: 来源: 题型:选择题
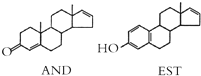
| A. | AND和EST都能使酸性 KMnO4溶液褪色 | |
| B. | AND和EST两者的相对分子质量之差为14 | |
| C. | AND和EST分别与足量氢气加成后的两种生成物互为同系物 | |
| D. | AND和EST与溴水完全反应消耗溴单质的物质的量之比为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com