
科目: 来源: 题型:解答题
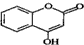 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: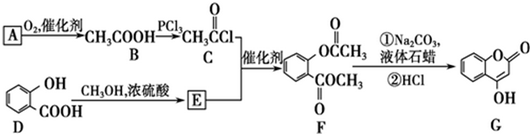
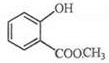 .
.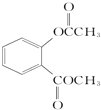 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
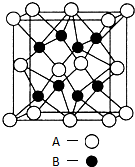 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
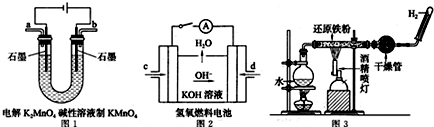
查看答案和解析>>
科目: 来源: 题型:选择题
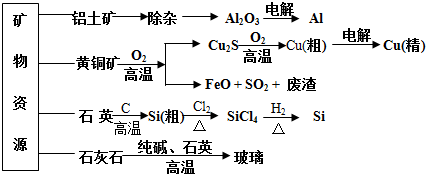
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
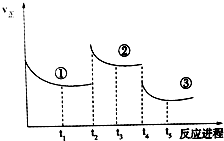 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )| A. | t2~t3时间段,平衡向逆反应方向移动 | |
| B. | t4时刻改变的条件是减小压强 | |
| C. | 平衡状态①和②,SO2转化率相同 | |
| D. | 平衡状态①和②,平衡常数K值相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
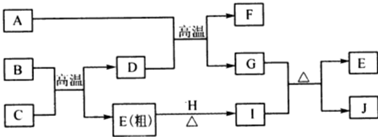
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
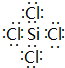 .
. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com