
科目: 来源: 题型:选择题
| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目: 来源: 题型:解答题
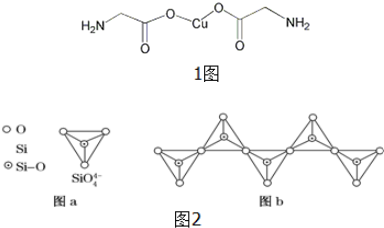
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目: 来源: 题型:解答题
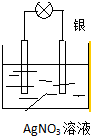 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.查看答案和解析>>
科目: 来源: 题型:解答题
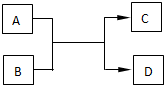 学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.
学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com