
科目: 来源: 题型:填空题
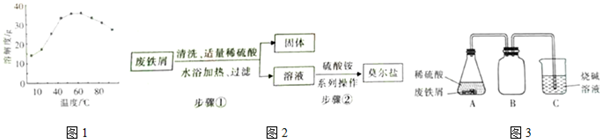
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH3COCH3)/mol•L-1 | 2.500 | 2.500 | 1.250 | 2.500 |
| c(HCl)/mol•L-1 | 0.500 | 1.000 | 1.000 | 1.000 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.010 | 0.020 |
| v(I2)/10-6 mol•L-1•s-1 | 1.500 | 3.000 | 1.498 | 3.000 |
| A. | I2的起始浓度越大,反应速率越大 | |
| B. | 该反应中HCl是催化剂,c(HCl)的改变不会影响反应速率 | |
| C. | 实验2与实验4两组实验的实验时间相等 | |
| D. | v(I2)/[c(CH3COCH3)•c(HCl)]为常数 |
查看答案和解析>>
科目: 来源: 题型:选择题
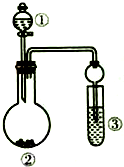 利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓氨水 | CaO | 滴有酚酞的水 | 氨气显碱性 |
| B | 浓盐酸 | MnO2 | 淀粉碘化钾溶液 | 氧化性:Cl2>I2 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均能反应生成白色沉淀 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:硫>碳>硅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①是BaCl2溶液,②稀盐酸 | B. | ①是稀盐酸,②稀BaCl2溶液 | ||
| C. | ①是稀硝酸,②是AgNO3溶液 | D. | ①是稀硫酸,②是AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com