
科目: 来源: 题型:解答题
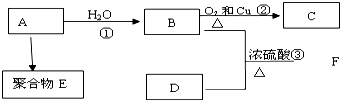
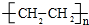 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔点:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氢量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
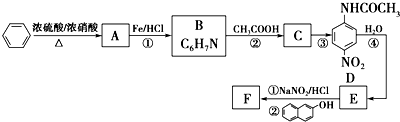
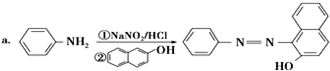
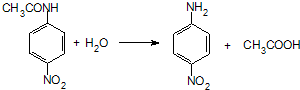 .
.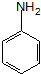 ;设计反应②和④的目的是保护氨基不被氧化.
;设计反应②和④的目的是保护氨基不被氧化.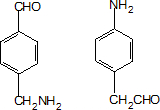 .
.查看答案和解析>>
科目: 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
查看答案和解析>>
科目: 来源: 题型:填空题
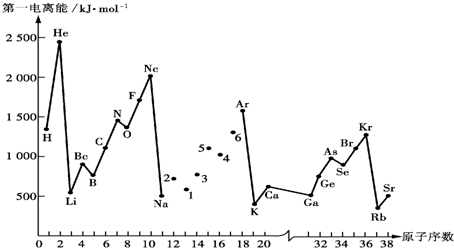
 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
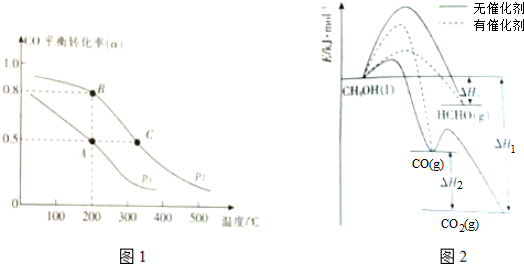
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com