
科目: 来源: 题型:填空题
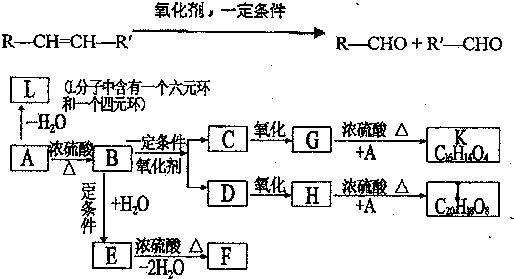
 、K
、K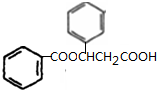 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$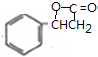 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应;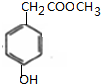 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目: 来源: 题型:选择题
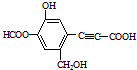
| A. | 该有机物分子式为:C11H10O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 | |
| D. | 1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com