
科目: 来源: 题型:选择题
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Fe+O2+2H2O═2Fe(OH)2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2H2+O2═2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WO3和水反应形成的化合物是离子化合物 | |
| D. | 原子半径:Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
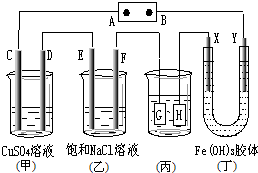
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:02+2H20+4e-═40H- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
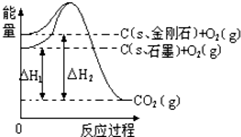
| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
查看答案和解析>>
科目: 来源: 题型:填空题
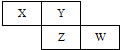 X、Y、Z、W四种短周期元素在周期表中的位置关系如图
X、Y、Z、W四种短周期元素在周期表中的位置关系如图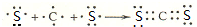 .
.查看答案和解析>>
科目: 来源: 题型:填空题
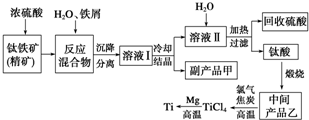 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 取1ml20%蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,取少量溶液,加入少量新制的Cu(OH)2,加热,没有砖红色沉淀生成 | 蔗糖没有水解 |
| B | SO2通入Ba(NO3)2溶液,生成白色沉淀 | 生成白色Ba(SO3)2沉淀 |
| C | 铜放入稀硫酸中无明显现象,再加入硝酸钠固体,有明显的气泡冒出,溶液变蓝,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向盛有3mL约5%的H2O2溶液中加入1~2滴1mol/LFeCl3溶液;有大量气泡出现,能使带火星的火柴梗复燃 | FeCl3可以催化H2O2分解的反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ca(HCO3)2 | B. | Na2SiO3 | C. | FeCl2 | D. | AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com