
科目: 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知在298K时下述反应的有关数据:C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,则C(s)+CO2(g)═2CO(g)△H=-172.5 kJ•mol-1 | |
| B. | KI溶液中滴加过量氯水发生反应的离子方程式为3Cl2+I-+3H2O═6H++IO3-+6Cl- | |
| C. | 等物质的量的NH4HCO3与Ba(OH)2 溶液混合反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| D. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) | |
| B. | 浓度均为0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) | |
| C. | 3 L 0.1 mol•L-1CH3COOH溶液和1L 0.3 mol•L-1CH3COOH溶液中的H+离子数 | |
| D. | 中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有些药物的标签上注明必须冷藏 | |
| B. | 铵态氮肥与草木灰不能同时施用 | |
| C. | 在接触室中加入五氧化二钒使二氧化硫与氧气在其表面反应 | |
| D. | 劈碎的木材燃烧更旺 |
查看答案和解析>>
科目: 来源: 题型:解答题
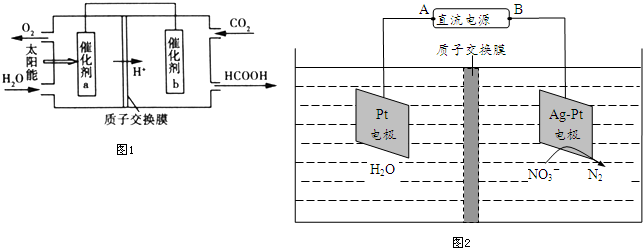
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 ( b-2a ) mol/L | B. | 10 ( 2a-b ) mol/L | ||
| C. | 10 ( b-a ) mol/L | D. | 10 ( b-2a ) mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NH3+3Cl2═N2+6HCl | B. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2S的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3的电离:NaHCO3 ?Na++H++CO32- | |
| C. | HSO3-的电离:HSO3-?H++SO32- | |
| D. | 钢铁的电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com