
科目: 来源: 题型:选择题
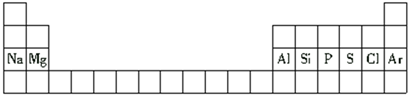
| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目: 来源: 题型:解答题
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示: ;
;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
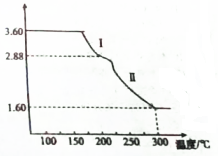 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com