
科目: 来源: 题型:选择题
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 乙醇、乙酸和乙酸乙酯可以用饱和碳酸钠溶液鉴别 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 甘氨酸(NH2-CH2-COOH)既能与NaOH反应,又能与盐酸反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫化羰的电子式为 | |
| B. | 硫化羰分子中三个原子位于同一直线上 | |
| C. | 硫化羰的沸点比二氧化碳的高 | |
| D. | 硫化羰在O2中完全燃烧后的产物是CO2和SO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
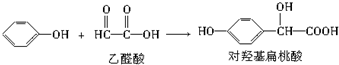
| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应. | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
查看答案和解析>>
科目: 来源: 题型:解答题
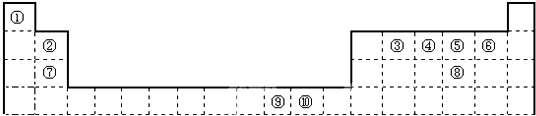
查看答案和解析>>
科目: 来源: 题型:解答题
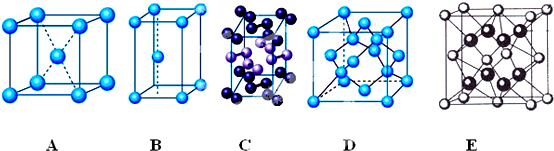
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com