
科目: 来源: 题型:解答题
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.查看答案和解析>>
科目: 来源: 题型:解答题
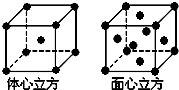
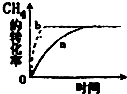 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.查看答案和解析>>
科目: 来源: 题型:解答题
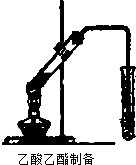 某校化学兴趣学习小组实验探究乙醇的性质.
某校化学兴趣学习小组实验探究乙醇的性质.查看答案和解析>>
科目: 来源: 题型:解答题
 根据如图原电池的装置图回答下列问题:
根据如图原电池的装置图回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
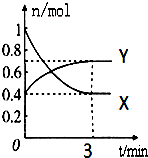 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
| A | B | C | |
| D |
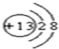
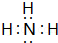 ,Y的结构式为
,Y的结构式为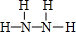 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH碱性比KOH强 | |
| B. | Li是最活泼的金属,F是最活泼的非金属 | |
| C. | X2+核外电子数目为18,则X在第四周期第ⅡA族 | |
| D. | 元素周期表有7个副族,7个主族,1个0族,1个Ⅷ族,共16个纵行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 左下方区域的金属元素 | |
| B. | 右上方区域的某些非金属元素 | |
| C. | 金属元素和非金属元素分界线附近的元素 | |
| D. | 过渡元素区域 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 推广使用燃煤脱硫技术,防治S02对空气的污染 | |
| D. | 废旧电池中的汞、镉、铅等重金属元素对土壤和水源会造成污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com