
科目: 来源: 题型:解答题
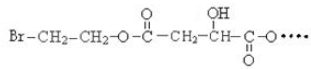
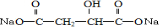 BHOCH2CH2OHC
BHOCH2CH2OHC D
D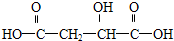
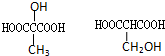
 .
.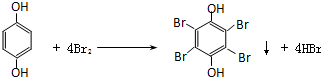 .
.查看答案和解析>>
科目: 来源: 题型:选择题
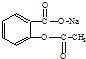 转变为
转变为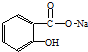 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
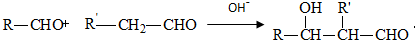 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: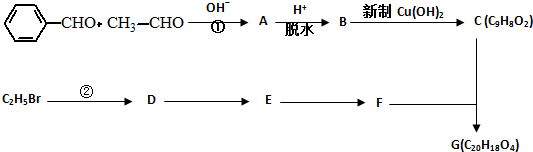
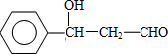 ;F的结构简式:CH2OHCH2OH;
;F的结构简式:CH2OHCH2OH; .
.查看答案和解析>>
科目: 来源: 题型:解答题
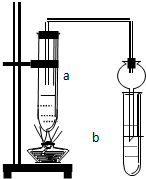 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②蛋白质(NaCl) | (3) | (2) |
| ③肥皂(甘油) | (1) | (7) |
| ④乙醇(水) | (4) | (3) |
| ⑤乙酸乙酯(乙酸) | (5) | (4) |
| ⑥乙烷(乙烯) | (6) | (6) |
查看答案和解析>>
科目: 来源: 题型:解答题
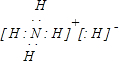 .
.查看答案和解析>>
科目: 来源: 题型:解答题
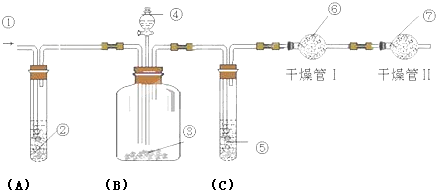
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
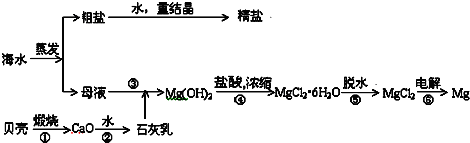
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com