
科目: 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||||||
| C. | 已知某些化学键的键能数据如下表:
| |||||||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
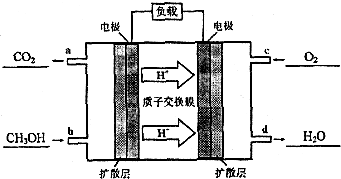 (1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%
(1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温时,NaNO2溶液的pH=8,则该溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:H++SO42++Ba2++OH-═BaSO4↓+H2O | |
| C. | 常温下物质的量浓度相等的下列四种溶液:①NH4HSO4;②CH3COONH4;③NH4Cl;④NH4Fe(SO4)2,四种溶液中c(NH4+)比较:②>①>④>③ | |
| D. | 常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液:Na+、K+、SiO32-、NO3-可以常量共存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 先热过滤,后常温减压过滤 | B. | 先常温常压过滤,后常温减压过滤 | ||
| C. | 先常温减压过滤,后热过滤 | D. | 两次都用减压过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 当溶液发生过饱和现象时,用玻璃棒轻轻摩擦器壁. | 促使晶体析出 |
| B | 将一块擦去氧化膜的铝片放在浓硝酸中,一段时间后取出洗净,再放入一定浓度的CuSO4溶液中. | 验证Al在浓硝酸中的钝化 |
| C | 在食醋总酸含量测定实验中,用25mL移液管吸取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度线,摇匀得待测食醋溶液 | 主要是防止食醋的挥发而导致实验误差. |
| D | 把两根碳棒放在酒精喷灯火焰上灼烧2~3分钟后,立即投入到冷水中,反复操作3~5次. | 可以使碳棒表面变得粗糙多孔,便于吸收更多的气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的溶液中,NO3-、Na+、I-、Fe2+ | |
| B. | pH=13的溶液中,Cl-、Mg2+、CH3COO-、K+ | |
| C. | 水电离出的c(H+)=1×10-12mol•L-1溶液中,HCO3-、SO42-、Na+、NH4+ | |
| D. | pH=14的无色透明溶液中,K+、Na+、NO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com