
科目: 来源: 题型:多选题
| A. | 氨气通入稀硫酸中:NH3+H+═NH4+ | |
| B. | 小苏打溶液和烧碱溶液反应:HCO3-+2OH-═CO32-+H2O | |
| C. | 一小块金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 澄清石灰水中加入过量硝酸:H++OH-═H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+ Mg2+ Cl- SO42- | B. | K+ Na+ Cl- HCO3- | ||
| C. | Fe2+ K+ NO3- SO42- | D. | K+ Ba2+ NO3- Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖能发生银镜反应 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖与蔗糖是同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
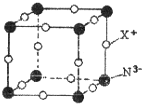 氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.查看答案和解析>>
科目: 来源: 题型:解答题
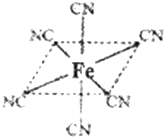 第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.查看答案和解析>>
科目: 来源: 题型:解答题
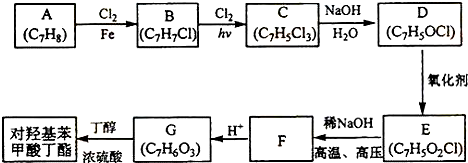
 ,该反应的类型为取代反应;
,该反应的类型为取代反应; ;
;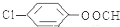 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
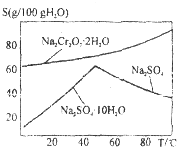 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com