
科目: 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |
查看答案和解析>>
科目: 来源: 题型:选择题
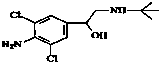 今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )
今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质可与盐酸反应 | |
| C. | 该物质的核磁共振氢谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 粒子半径:Na+>Mg2+>S2->Cl- | B. | 热稳定性:SiH4<PH3<H2S<HCl | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性:HF<HCl<HBr<HI |
查看答案和解析>>
科目: 来源: 题型:填空题
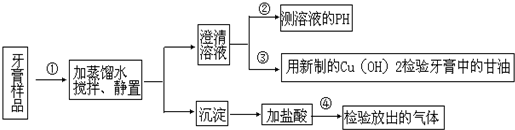
查看答案和解析>>
科目: 来源: 题型:解答题
 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA个.
;1mol O22+中含有的π键数目为2NA个.查看答案和解析>>
科目: 来源: 题型:解答题
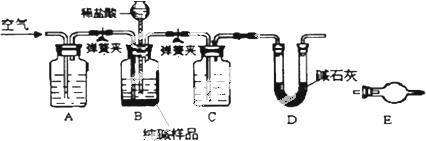
查看答案和解析>>
科目: 来源: 题型:解答题
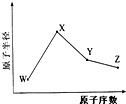 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | B. | 简单离子半径:W>Y>Z>X | ||
| C. | 原子半径:W>Y>Z>X | D. | 原子的得电子能力:X<Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子晶体中相对分子质量大的熔、沸点一定比相对分子质量小的高 | |
| B. | 在氯化钠晶体中,每个氯离子周围都紧邻12个氯离子 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 金刚石的网状结构中,最小的环上有6个碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com