
科目: 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目: 来源: 题型:解答题
 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
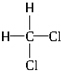 和
和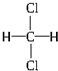 ③35Cl和37Cl
③35Cl和37Cl 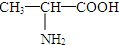 和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3
和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3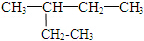 和
和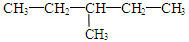
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 食盐溶液作为电解质溶液形成原电池 | |
| C. | 银器为正极,Ag2S被还原生成单质银 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2 mol/(L•min) | B. | 0.6 mol/(L•min) | C. | 0.1 mol/(L•min) | D. | 0.3 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 在苯中滴入浓硝酸制硝基苯 | |
| C. | 用乙醇和乙酸混合共热制取乙酸乙酯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| B. | 标准状况下,22.4 L 苯含有nA个苯分子 | |
| C. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| D. | 标准状况下,2.24 LCH4和C2H4混合气体中含有的H原子数为0.4nA |
查看答案和解析>>
科目: 来源: 题型:选择题
 ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 与NaOH溶液共热可生成一种钠盐 | ||
| C. | 能催化加氢生成2甲基丙酸甲酯 | D. | 能发生缩聚反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
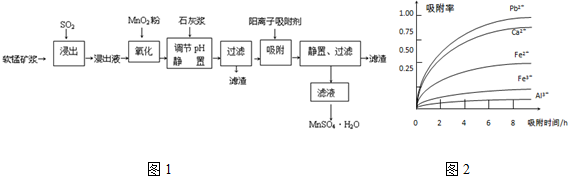
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com