
科目: 来源: 题型:选择题
| A. | SiO2、NaCl、CO2 | B. | HF、HCl、HBr | C. | NaCl、KCl、RbCl | D. | Na、Mg、Al |
查看答案和解析>>
科目: 来源: 题型:选择题
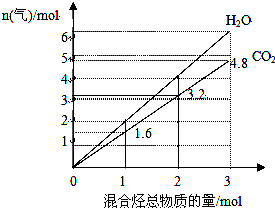 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有丙烷 | D. | 一定没有丙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PH3是非极性分子 | B. | PH3分子中有未成键的电子对 | ||
| C. | PH3是强氧化剂 | D. | PH3分子中的P-H键是非极性键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体,都能水解为还原性的糖 | |
| B. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| C. | 鸡蛋白溶液中加入浓的硫酸铵溶液有沉淀析出,加水后沉淀不溶解 | |
| D. | 天然油脂有的具有固定的熔沸点,植物油不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
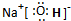 物质I是极性分子(填极性或非极性)
物质I是极性分子(填极性或非极性)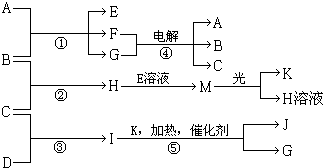
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g•cm-3 | |
| B. | 此溶液中KCl的质量分数为$\frac{74.5}{1.174×1000}$×100% | |
| C. | 密度大于1.174 g•cm-3的KCl溶液是过饱和溶液 | |
| D. | 25℃时,饱和KCl溶液的浓度大于4.0 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.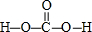 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com