
科目: 来源: 题型:选择题
| A. | 都可用(C6H10O5)n表示,淀粉有甜味,而纤维素没有 | |
| B. | 二者含C、H、O三种元素的质量分数相同,但不是同分异构体 | |
| C. | 它们都属于糖类,且都是高分子化合物 | |
| D. | 两者在工业上都可以用作生产葡萄糖的原料 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| 分散质 | Mg(OH)2 | HCl | NH4Cl |
| 备注 | 悬浊液 | 1mol/L | 1mol/L |
| A. | 向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动 | |
| B. | 向①中加入酚酞显红色,说明物质的“不溶性”是相对的 | |
| C. | 向①中加入③,沉淀溶解,说明Mg(OH)2比NH3•H2O更难电离 | |
| D. | ①③混合后发生反应:Mg(OH)2(s)+2NH4+?Mg2++2NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食物放在冰箱里 | B. | 在糕点包装内放置小包除氧剂 | ||
| C. | 燃煤发电时用煤粉代替煤块 | D. | 塑料制品中添加抑制剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
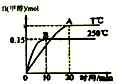
| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
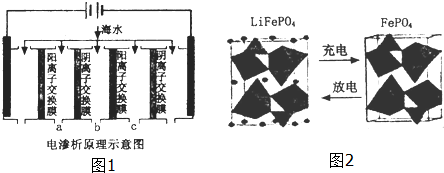
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com