
科目: 来源: 题型:选择题
| A. | 秸秆就地焚烧 | B. | 秸秆粉碎还田 | C. | 秸秆生产沼气 | D. | 秸秆造纸 |
查看答案和解析>>
科目: 来源: 题型:解答题
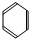
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.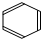 在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O.
在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.01 mol/(L•min) | D. | v(NH3)=0.17 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O与D2O属同系物 | |
| B. | 35Cl与37Cl属同素异形体 | |
| C. | O2与O3属同位素 | |
| D. | 乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
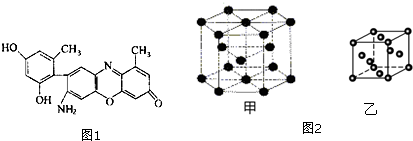
查看答案和解析>>
科目: 来源: 题型:解答题
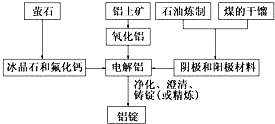 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过渡元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即有18个族 | |
| C. | 短周期是指第一、二、三、四周期 | |
| D. | VA族的元素全部是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com