
科目: 来源: 题型:阅读理解

| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
查看答案和解析>>
科目: 来源: 题型:
 (2010?江苏)乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
(2010?江苏)乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.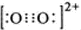
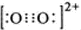
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
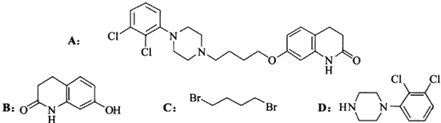
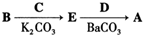
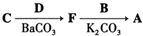
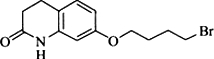

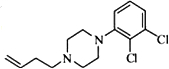

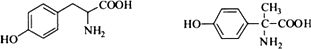
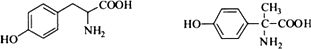
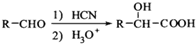 ,写出由C制备化合物
,写出由C制备化合物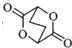 的合成路线流程图(无机试剂任选). (合成路线流程图示例如下:
的合成路线流程图(无机试剂任选). (合成路线流程图示例如下: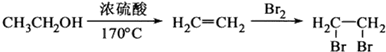 )
)

查看答案和解析>>
科目: 来源: 题型:阅读理解
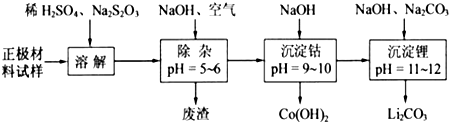

查看答案和解析>>
科目: 来源: 题型:

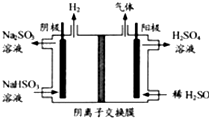
查看答案和解析>>
科目: 来源: 题型:阅读理解
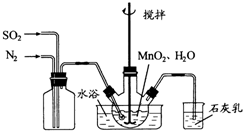 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: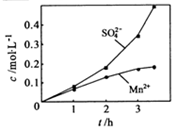
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com