
科目: 来源: 题型:解答题
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
查看答案和解析>>
科目: 来源: 题型:填空题
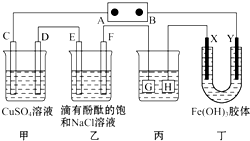 如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答:
如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某物质的水溶液PH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
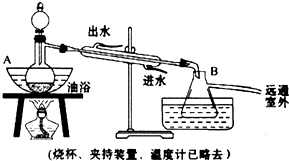 后静置,放出水层(废液).
后静置,放出水层(废液).查看答案和解析>>
科目: 来源: 题型:解答题
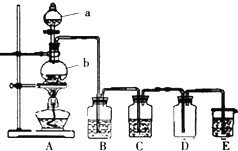
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
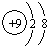 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com