
科目: 来源: 题型:填空题
 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a:(b+c+d)=1:1.5 | B. | (a+b):(c+d)=1:1 | C. | a=b=c=d=1.12L | D. | a+b+c=d=0.2mol |
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2-湿润的KI淀粉试纸-红色 | B. | NH3-湿润的蓝色石蕊试纸-红色 | ||
| C. | NH3-湿润的PH试纸-红色 | D. | NO2-湿润的KI淀粉试纸-蓝色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
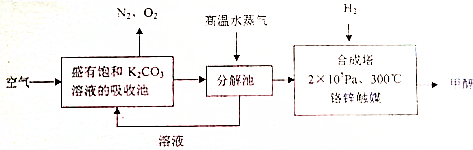
查看答案和解析>>
科目: 来源: 题型:解答题
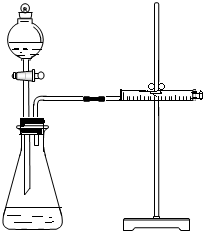 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com