
科目: 来源: 题型:选择题
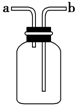
| A. | 洗气装置:瓶内放一定体积溶液,由a管口进气 | |
| B. | 收集不溶于水的气体:瓶内充满水,由b管口进气 | |
| C. | 排空气法收集氧气:由a管口进气 | |
| D. | 排空气法收集氢气:由a管口进气 |
查看答案和解析>>
科目: 来源: 题型:解答题
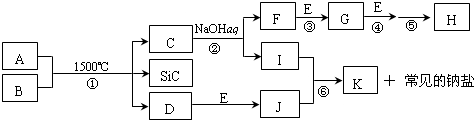
查看答案和解析>>
科目: 来源: 题型:填空题
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:选择题
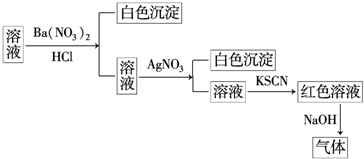
| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
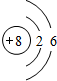 .
.查看答案和解析>>
科目: 来源: 题型:解答题
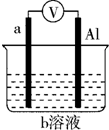 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.1 mol电子,理论上生成20.7 g Pb | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com