
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
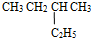 和
和 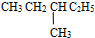 ⑤
⑤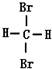 和
和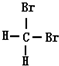
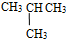 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH查看答案和解析>>
科目: 来源: 题型:解答题
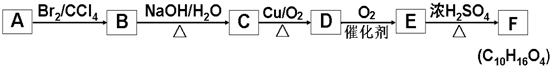
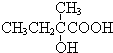
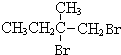 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$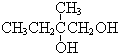 +2NaBr,反应类型取代反应
+2NaBr,反应类型取代反应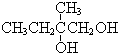 +O2+O2$\stackrel{催化剂}{→}$2
+O2+O2$\stackrel{催化剂}{→}$2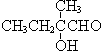 +2H2O,反应类型氧化反应
+2H2O,反应类型氧化反应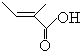 、
、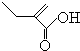 .
.查看答案和解析>>
科目: 来源: 题型:填空题
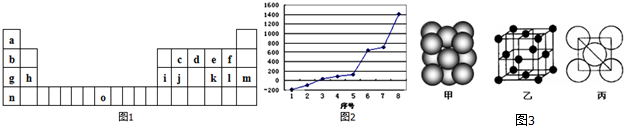
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 步骤序号 | 操作 | 实验现象 | 判 断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填离子符号) |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有NH4+ (填离子符号) |
| 结论:此白色固体可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
查看答案和解析>>
科目: 来源: 题型:解答题
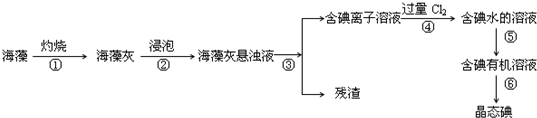
查看答案和解析>>
科目: 来源: 题型:解答题
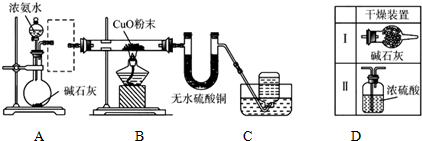
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com