
科目: 来源: 题型:解答题
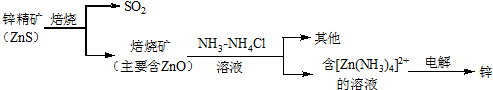
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
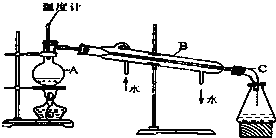 如图是某学生绘制的实验室蒸馏石油的装置图:
如图是某学生绘制的实验室蒸馏石油的装置图:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
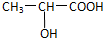
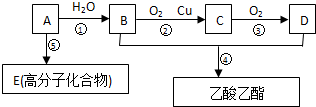
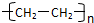

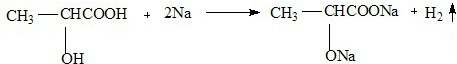 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
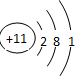
查看答案和解析>>
科目: 来源: 题型:解答题
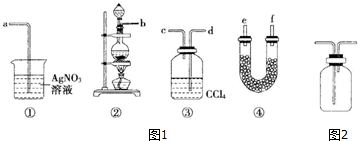
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com